|
たばこ産業 塩専売版 1985.9.25
「塩の科学」シリーズ
日本たばこ産業株式会社塩技術調査室室長
橋本壽夫
海水からの塩づくり 1
イオン交換膜製塩法の概要
塩は私たちの生活にとって不可欠な物である。それは衣食住のすべてに利用されており、塩がなくては現代の生活は成り立たない。食用の塩は大部分が国内で海水を原料として、イオン交換膜製塩法によりつくられている。世界の塩生産量は約1億7千万t(1982年)であり、その7割は岩塩に由来するが、それも元をただせば海水からできたものである。現在海水から直接つくられている塩は3割程度にすぎない。日本は国内需要の大半を海外からの輸入に仰いであるが、出荷適地の関係から、これらの輸入塩はすべて海水を原料とした天日塩であり、岩塩は輸入されていない。日本の塩消費量は約800万tで、このうち600万t強はソーダ工業用の原料となり、その製品から衣類や住宅の素材が作られ、食料用を含めたその他の用途には約180万tが消費されている。今回は海水からの塩づくりの科学として、塩づくりの解説を試みることにした。
炭酸カルシウム、石膏、塩の順に結晶
海水中にはほとんどすべての元素が含まれているといってよい。その中で水を構成する水素と酸素を除き最も多い元素は塩素で、次にナトリウム、マグネシウム、硫黄(硫酸イオンとして存在)、カルシウム、カリウムという順になっている。これらは、水の中では、プラスまたはマイナスの電荷を持っており、それぞれプラス(陽)イオン、マイナス(陰)イオンとして存在している。それぞれのイオンの組み合わせでできる化合物が水に溶ける濃度(溶解度)は決まっており、海水が濃縮されるにつれて、溶解度の小さい物質から順に結晶となってくる。
海水ではカルシウムイオンと炭酸イオンの組み合わせである炭酸カルシウム(貝の殻の成分、ヤカンの内側にざらざらした状態でついていることがある)が最も溶解度が小さいため、最初に結晶となり、次にカルシウムイオンと硫酸イオンの組み合わせである石膏(硫酸カルシウム)が出てくる。その後、塩が析出を始めるようになる。
海水の約90%を蒸発させてつくる天日塩
容器に1ℓの海水を入れ、水分をすべて蒸発させて残った固形物の重さを量ると33~35 gくらいある。この中に塩は78%くらいあるので、26~27 gが塩ということになる。海水中には3%の塩があるというのは、この数値の概略値である。
海水を自然に蒸発させて塩をつくる天日塩田では、海水の約90%を蒸発させないと塩は出てこない。すなわち、最初の量の10分の1まで濃縮しないと塩を採ることができないのである。このように濃縮された液をかん水という。
塩が出てくるまでに、炭酸カルシウムや石膏が出てくる。岩塩鉱では底にこれらの層があり、その上に岩塩層がある。塩田では塩が出てくる時にそれらと混じると、純度が下がり品質が悪くなるので、塩を採る結晶池の前に石膏を沈殿させる調整池がある。さらにその前に蒸発池がある。
結晶池でも、まだ石膏は出るが量は少なく、塩と混じりながら、塩の方がどんどん出てくる。やがて最初の海水量の40分の1くらいまで濃縮されると硫酸マグネシウム(緩下剤として使われる)が出始めて、塩の純度が悪くなるので、その前に濃縮された液(にがりであるが、塩を生み出す液であることから母液ともいう)を流し出して、塩をすき起こして集め収穫する。
結晶池ではできるだけ純度によい塩を効率よく採るために、結晶池に入れるかん水の濃度と結晶池内の母液の濃度をよく管理している。収穫した塩にはまわりに母液がついているので、食塩水でよく洗って、水切りした後出荷する。
こうして日本に輸出されてくる天日塩の純度は97%くらいである。この塩は鉱石や石炭と同じように取り扱われ、土砂や小石、鉄さびなどが入っているため、そのままでは食用に適さない。そこで、この塩を一度真水に溶かしてごみや不純物を除き、真空蒸発缶で煮詰めてつくった塩が精製塩、食卓塩であ
る。
わが国の気象条件が生んだ製塩法
日本では、自然の力を利用して天日塩をつくれるほど気象条件が塩づくりに適していないため、自然の力の利用も海水を濃縮する部分に限られ、塩の結晶を析出させるのは別の工程というように、製塩工程を二つに分けなければならなかった。前者を採かん工程といい、後者のかん水を煮詰めて塩をつくる工程をせんごう工程といっている。採かん工程は、昔は塩田で行っていたが、今ではイオン交換膜透析法で行っている。
イオン交換膜とは、水の中にあるイオンだけをわずかな水と一緒に通す篩(ふるい)の役目をする膜で、陽イオン交換膜と陰イオン交換膜がある。陽イオン交換膜は陽イオンだけを、陰イオン交換膜は陰イオンだけを通す。
海水中には陽イオンとしてナトリウム、カリウム、カルシウム、マグネシウムイオンなどがあるので、陽イオン交換膜はこれらのイオンだけを通すが、中でもカルシウム、マグネシウムイオンは大きいので通りにくく、ナトリウム、カリウムイオンがよく通る。陰イオンとしては、塩素、炭酸、硫酸イオンなどがあるので、陰イオン交換膜はこれらのイオンを通すが、炭酸、硫酸イオンは大きくて通りにくく、塩化物イオンがよく通る。
米と稗(ひえ)を篩い分けるには、篩の高さを維持するエネルギーと、篩を振動させるエネルギーがいるように、イオンを膜で篩い分けるにもエネルギーが必要である。そのエネルギーは電気が担っている。
鉄は磁石に吸いつけられるが、アルミや銅は吸いつけられない。鉄片は磁石が近づくと一端がプラスに、他端がマイナスに帯電する(分極という)のでくっつくのである。アルミや銅は分極しないので、くっつかない。
塩は水に溶けるとナトリウムイオンと塩化物イオンになっているので、電気のプラス極とマイナス極を塩水の中に漬けて、直流の電気を流すと、ナトリウムイオンはプラスに帯電しているからマイナス極の方へ、塩化物イオンはマイナスに帯電しているからプラス極の方へ引きつけられて移動する。砂糖は水に溶けてもイオンとならないので、電極の方へ移動することはない。
塩が水に溶けると、ナトリウムイオンと塩化物イオンに分かれるということは非常に大切なことで、ナトリウムイオンは人間の体の中でカリウムやカルシウムイオンとともに、刺激を電気として脳や筋肉に伝える上で重要な働きをしているといわれている。
蒸発法に比べ格段の省エネルギー
イオン交換膜法でかん水を採る原理を説明する(図参照)。海水の中に陽イオン交換膜と陰イオン交換膜を交互に置いて両端に電極を入れて、直流の電気を流すと、海水中の陽イオンは陰極に,陰イオンは陽極に移動する。その時イオン交換膜という篩があって、通れるイオンと通れないイオンが出てくるので、結果としては、一つ置きに塩水の濃い所と薄い所ができる。
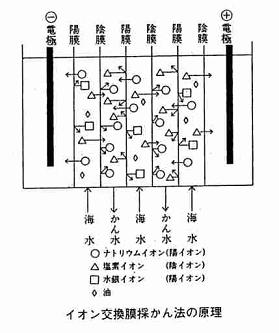
篩を振動させる代わりに、交換膜では海水が薄くなった所に新しい海水をたえず流してやり、濃い所にたまったかん水を集める方法がイオン交換膜採かん法である。
蒸発法のように多くの水を蒸発させるために莫大なエネルギーを使うことなく、塩をつくるのに必要なナトリウムイオンと塩化物イオンだけを集めるのでエネルギーが少なくてよい。
ちなみに現在使われている膜では、1 kgの塩を海水の中から集めるのに必要なエネルギーは172 kcalである。すなわち、塩の濃度26 g/ℓの海水を200 g/ℓのかん水に濃縮するのに約200 W時必要であるから熱量に(1 W時は860 cal)すると200 W時×860 cal/W時は172 kcalとなる。
一方、これを水の蒸発によって濃縮するためには200 g/ℓ÷26 g/ℓで約8倍(200÷26≒8)に濃縮しなければならないため8分の7の水を蒸発させることになる。海水は1 kg÷26 g/ℓの38 ℓ(1,000 g÷26=38 ℓ)必要であるから、蒸発水分量は38 ℓの8分の7の33 ℓとなり、これを熱量換算すると33 ℓ×540 kcal/ℓは1万7千820 kcal(33×540=17,820)となって、イオン交換膜法の約100倍のエネルギーを要する。
また、海水の中に危険な毒物が含まれていても、イオンになっていない物は入ってこないし、イオンになっていてもナトリウムや塩化物イオンよりも大きいので、イオン交換膜で篩い分けられて、かん水の中には入ってこない。
このかん水を煮詰めて塩をつくるが、煮詰めの部分の科学は次の機会にゆずる。
|