|
たばこ塩産業 塩事業版 1997.12.25
塩なんでもQ&A
(財)塩事業センター技術部調査役
橋本壽夫
塩が融氷雪剤に利用される理由は?!
道路に積もった雪を溶かすために塩が使われていると聞きましたが、どうして塩で雪が溶けるのですか?子供の頃、理科の実験で氷に塩を振りかけ、温度を下げて試験管でアイスクリームを作った経験があるのですが、塩で雪を溶かす、ということと矛盾するような気がします。そのへんのことを詳しく教えて下さい。
(熊本県・会社員)
塩類濃度が高くなると凍る温度は低くなる
塩を使って雪や氷を溶かすことは、冬期に自動車が安全に道路を走れるようにする上で、非常に重要なことです。これにより降雪時期でも交通が確保され,事故が起こることが少なくなるからです。
寒くなると池や湖の水は凍っても、海の水は凍らないことは経験的に知っています。
しかし、北極や南極の海が凍っているように、海の水でも、もっと寒くなると凍ってしまいます。
塩が溶けて塩水になると、塩の溶けている濃度によって塩水が凍る温度(氷点という)が変わってくるのです。すなわち、塩の濃度が高いほど凍る温度は低くなります。この性質は塩だけでなく、水に溶ける物の一般的な性質で「氷点降下」といいます。
図1に、その様子を塩(NaCl)、塩化マグネシウム(MgCl2)、塩化カルシウム(CaCl2)という三種類の塩類について示しました。
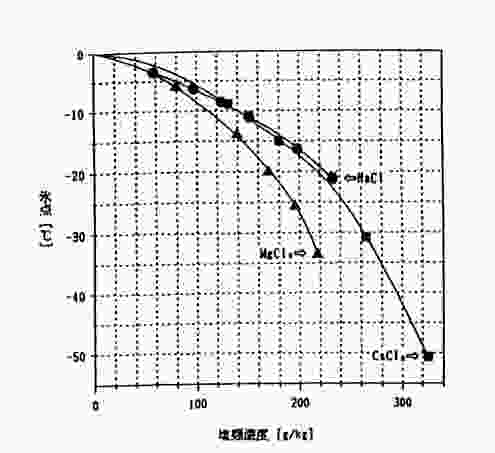
図1 塩類溶液の氷点
図1を見ると、水は0℃で凍りますが、塩類濃度が高くなるにつれて氷点は徐々に下がっていくことが分かります。しかし、NaClは約マイナス21℃、CaCl2は約マイナス51℃までしかデータがありません。その理由は、それぞれの塩類の飽和濃度の氷点になるからです。
この図からは温度の低い、例えば、マイナス25℃の場合には塩水は凍ってしまいますが24%以上の塩化カルシウム溶液は凍らないことを表しています。
理科の実験で、氷に塩を振りかけてアイスクリームやアイスキャンデーが作れるのは、この塩の氷点降下を利用して、冷たい塩水や氷を作れるからです。氷に塩を振りかけてかき混ぜると、氷自身の熱を奪って一部分の氷と塩が溶けて、氷や塩水の温度が下がっていきます。塩も氷も存在する状態では最終的には約マイナス21℃まで下がります。その中にアイスクリームやアイスキャンデーになる溶液の入った試験管を入れれば、マイナス21℃の温度で冷やされて、中の溶液が固まるわけです。
この原理を利用して、産業的には魚を凍結させることが行われています。獲れた魚を船の上で低温の塩水に漬けて凍らせて、鮮度を保つわけです。
氷点降下の利用により融氷雪の効果を発揮
前の節では水を凍らせる方向から考えて、塩水中では氷点が下がることを述べました。
ここでは氷が溶ける方向から考えてみましょう。
0℃の氷は溶けると0℃の水になることは誰でも知っています。しかし、これは水の中に氷がある場合のことで、自然の状態では、氷を溶かすのに必要な熱は日光や0℃より高い空気や大地から与えられます。気温や地温が0℃より高ければ高いほど、氷は速く溶けますが、それらの温度が0℃に近づくにつれて溶けにくくなり、0℃以下では溶けなくなります。
それでは一番濃度の濃い塩の飽和溶液中の氷について考えてみましょう。この場合には、氷はマイナス21℃で溶けて温度がマイナス21℃の塩の飽和溶液になります。この時に必要な熱はやはり空気や大地から与えられます。猛吹雪の天候でも気温や地温がマイナス21℃以上であれば、塩の結晶と接している雪や氷は溶けていきます。これが塩を撒くと雪や氷が溶ける原理です。周囲の温度が21℃よりも高いほど速く氷が溶けることになりますが、マイナス21℃に近づくにつれて溶けにくくなります。
しかし、現実的にはこのようにはなりません。塩が溶ければ塩の濃度が薄くなって氷点が高くなってしまい、氷が溶けなくなるからです。したがって、塩が融氷雪の効果を現実的に発揮できるのは、せいぜい気温がマイナス10℃程度までです。それ以上気温が下がるところでは、氷点が塩よりも低くなる塩化カルシウムのような物を使わなければなりません。
土壌塩性や地下水汚染など環境におよぼす影響もあり
便利な塩も自動車や橋を錆びさせ、土壌を塩性にして植物を枯れさせ、地下水を塩で汚染させる、といったことで環境におよぼす影響があります。
このような影響を最小限にするために、できるだけ少ない塩の散布量で大きな効果をあげられるようにすることが重要です。融氷雪用の塩使用量が非常に多い欧米では、適正散布量、気象予報の精度向上、道路表面の温度測定センサーの設置、散布時期の適正化、防錆剤の添加、塩に代わる融氷雪剤などについて研究が行われています。
塩粒は氷に孔を開けて舗装面から氷を剥がす
道路の表面が凍ると、自動車はハンドルやブレーキが効かなくなり、非常に危険になります。このような道路に塩を撒きますと、塩粒の周囲の氷は溶けて孔が開き、塩粒は沈みながらどんどん氷を溶かして、孔は氷を貫通してしまいます。すると塩水は舗装面を横に広がり、舗装面に付着している氷を溶かします。
これによって舗装面から氷が剥がれますので、このような状態の所に自動車が通ると、氷は割れて舗装面からはね飛ばされ舗装面が出てきます。
自動車の通行により塩水と氷は撹拌されて溶けやすくなり、まだ溶けていない氷も道路脇にはね飛ばされて道路から氷がなくなり、安全に自動車を運転できるようになる、というわけです。
入手容易・廉価・効果高く世界塩消費量の約15%に
融氷雪に使われる塩の量は1 m2当たり30〜50 g程度ですが、一冬の使用量にすると莫大な量になります。もっとも冬期の気象変動で消費量は大きく変化します。日本における使用量は次第に増加してきましたが、まだ20〜30万t程度です。欧米では非常に多く何百万tの単位で使われ、アメリカでは厳しい冬になると1千万tも散布することがあります。世界の塩消費量は2億t弱ですが、その約15%が融氷雪に使われています。
このように大量に使われることから、環境への影響が問題になり、環境に影響の少ない塩の代替物が研究され、使われています。
錆という問題では、塩化カルシウムや塩化マグネシウムは塩とそんなに変わりません。そこで有機物である酢酸カルシウム・マグネシウム(CMA)、エチレングリコール、尿素などが使われますが、非常にコストが高いのが難点です。それでも橋とか空港などでは使われるようです。
尿素を使うと雑草の生育がよくなるという別の問題が出てきます。場合によっては、これらの代替物を混合して使うこともあります。
これらの化合物が氷を溶かす能力は図2に示すように塩化カルシウムが一番大きく、次に塩が大きいことが分かります。
今のところ塩が、容易に入手でき、一番安く、効果も高い、ということで、最も多く使われています。
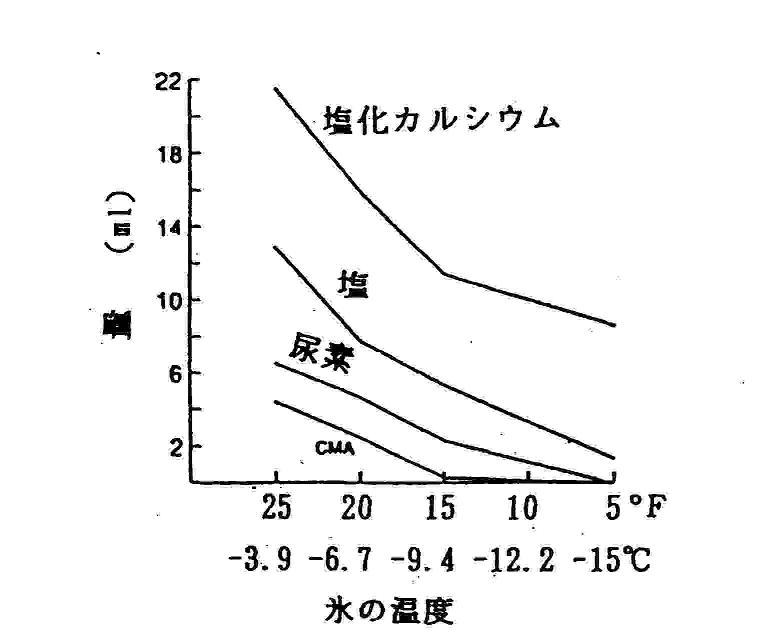
図2 20分間で溶解する氷の量
|