|
たばこ塩産業 塩事業版 2004.03.25
Encyclopedia[塩百科] 32
(財)ソルト・サイエンス研究財団専務理事
橋本壽夫
塩が多方面で利用される原理の説明
塩水の相平衡図
塩水は塩が水に溶けている状態の溶液である。溶液の濃度、温度を変化させると、液体と固体がそれぞれ単独で、または共存するいろいろな状態ができる。これらの状態を図に表したものを相平衡図という。相平衡図から晶析、氷の溶解、塩の低温固結といったいろいろな現象を説明することができる。多少理屈っぽくなるが、そのような現象を相平衡図から考えてみる。
水の状態を温度と圧力で表した図を「相平衡図」
最初に専門用語の相平衡図について解説する。相とは液体を液相、固体を固相、気体を気相と言うように物質の状態を表す。例えば、水の場合は0℃で液体(液相)から固体(固相)へ、またその逆に相が変化し、大気圧では100℃で液体から気体へ、またその逆に相が変化する。このように水の状態を温度と圧力で表した図を相平衡図という。
塩溶液の相平衡図を図1に示す。これは縦軸に温度(℃)、横軸に塩(NaCl)の濃度(%)を取って概念的に示したもので目盛りは正確ではなく、誇張されて示されている。いくつかの線で囲まれた領域が表されていることが分かる。
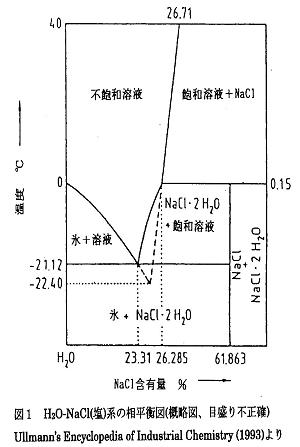
水は0℃で凍るので、0℃から始まる右下への下降線は塩溶液濃度の上昇に伴う氷点降下を表しており、塩分濃度が高いほど低い温度にならないと水は凍らないことを示している。この線より上では塩溶液であるが、この線より下では氷と塩溶液が共存している。
一方、40℃では塩の飽和濃度は26.71%であり、温度が下がるにつれて塩の飽和濃度が低下する線(直線に見えるが実は曲線で溶解度曲線である)が描かれている。
その線は0.15℃、26.285%の所に変曲点がある。この温度で塩の結晶は2分子の結晶水を持った2水塩に転移する。すなわち、結晶形が立方晶系から単斜晶系に変わる転移点である。
急速に冷却すると破線のように進み、氷点降下を示す線と-22.40℃のところで交わる。この点は2水塩との共晶点である。
つまりこの温度以下では、溶液は存在せず、氷と2水塩との結晶だけになる。この共晶点は準安定状態で、無水塩との共晶点である-21.12℃の安定した共晶点まで温度は上昇し、2水塩は溶けて濃度が23.31%とうすい飽和溶液となる。湾曲した線は2水塩の溶解度曲線である。
したがって、0.15℃以下では2水塩の塩結晶と飽和溶液が共存する領域になる。
しかし、塩分濃度が61.863%(NaCl/NaCl・2H2Oからの計算値)と言う高濃度になると、氷は存在せず、氷の水が総て塩の結晶水となって、無水塩と2水塩が共存した状態になる。
飽和溶液を冷却すると塩が析出「冷却晶析」
飽和溶液を冷却すると、例えば40℃から0.15℃まで冷却すると、塩濃度は26.71%から26.285%まで下がるので、0.425%分の塩が析出する。これが冷却晶析である。塩の溶解度は、温度が変化してもあまり変わらない。したがって、塩の生産工程では冷却晶析を利用することはない。塩の生産は蒸発工程を利用して行われる。塩の飽和溶液は108.7℃まで加熱しないと沸騰しない。水の沸騰温度は大気圧で100℃であるので、その温度との差8.7℃が沸点上昇(氷点降下に対する言葉)となる。
冷却晶析は塩の王冠などを作るときに利用される。竹ひごと糸で王冠や船など様々な形を作る。これを高い温度の飽和塩水に沈めて、ゆっくりと冷却させると、ひごに真白で大きな塩の結晶が付いてきらきらと輝く王冠ができる。
写真に示したのは塩事業センター海水総合研究所の玄関に飾られている見事な法隆寺の五重塔であ
る。

共晶点と気温の差から生じる「融氷雪作用」
塩は氷や雪を溶かして冬期の交通確保のために使われる。北アメリカでは一冬に日本で1年間に使用する量よりも多い1000万トン以上も使われることがある。これに使う塩は主として岩塩である。日本では輸入された天日塩が1冬に40〜50万トン使われる。
どうして塩が氷や雪を溶かすことが出来るのであろうか?この相平衡図から考えてみる。
氷に塩を撒くと、温度の高い(常温の)塩はわずかに氷を溶かす。すると、塩が固体である限り、その溶液は塩の飽和溶液となる。氷と塩が共存すると周囲から熱を奪って氷は溶け、飽和溶液の温度は共晶点の-21.12℃まで下がる。同時に氷の温度も-21.12℃まで下がる。ところが気温が0℃とすると、共晶点との間で21.12℃の温度差があるので、大気から熱を、あるいは周囲の温度の高い氷から熱をもらって氷は溶ける。氷が溶ければその水で塩も溶け、固体の塩がある限り、温度は-21.12℃に維持され、氷はどんどん溶けていく。
固体の塩がなくなるとどうなるか?飽和濃度を維持できなくなり、塩分濃度が次第に薄くなる。塩分濃度が薄くなるにつれて、その温度に対応した氷点降下の温度を示し、共晶点から0℃の方へ向かって氷と溶液が共存する温度は上昇していく。すると温度差が次第に小さくなり、氷を溶かす能力はなくなってくる。つまり、うすい塩溶液では氷を溶かす能力は小さい。
同じ理屈で、気温が低いほど共晶点との温度差が小さくなるので、氷を溶かす能力は小さくなる。10℃程度の温度差がないと、実用的な融氷効果はないので、気温が-10℃以下の極寒地では塩ではなく、もっと共晶点の低い塩化カルシウムが使われる。共晶点が-21.12℃であることを利用して、氷に塩を入れてかき混ぜ、そこに砂糖水を入れた容器を浸けて氷菓子を作ったり、獲れたばかりの活きの良い魚を氷のある状態の飽和塩水に浸けて凍結させ、冷凍庫に入れて港まで持ち帰る。
貯蔵中に低温が続くと単斜晶系「低温固結」へ
0.15℃を転移温度として無水塩が2水塩に転移する。この際、結晶形がサイコロ状の立方晶系から薄片状の単斜晶系に変わる。水分を含んだ塩が貯蔵中に低温になり0.15℃以下の状態が続くと、塩の結晶表面に付着して水膜を形成している水は塩の結晶水となり、単斜晶系の結晶形に転移するに伴い固結する。すなわち、粒状の塩が塊状に固まって粉体として取り扱えなくなり問題となる。これが低温固結である。水分が多いほど固結はひどくなる。これを避けるには、塩を乾燥させるか、温度を下げないようにするか、散塩の場合、雪や雨で濡らさないように貯蔵する。北海道では低温固結を起し、問題となることがある。
◆…今回は、塩水の相平衡図を使い、塩がいろいろと利用される原理を少し理屈っぽくなったが解説した。
|