人体のナトリウム制御
Sodium Regulation in the Human Body
By Heer, Martina
Current Sports Medicine Reports 2008;7:S3-S6 2008.07
要約
ナトリウム規制に関する従来の知識は、ナトリウムが消化管で完全に吸収され、腎臓から排泄されると言うものである。しかし、微小重力下で人間を使って行われた実験や地球上で行われた代謝病棟の実験は、ナトリウムが体液の保持やカリウム排泄量の増加なしに人体に保持される可能性があることを明確に示しており、浸透圧的に不活性なナトリウムの保持を示唆している。
はじめに
人体の恒常性には、体液量を維持し、電解質濃度を安定させることが不可欠である。体液量と電解質の恒常性に関連する調節メカニズムを理解するために、体液全体が主に細胞内と細胞外の2つの区画に分布していると仮定する。次に、細胞外区画は、血管内液量と間質液に分けられる。これらの2つの体液区画は陽イオンと陰イオンの特定の組成によって特徴付けられる。細胞外空間の主成分はNa+、Cl-、Ca2+、およびHCO3-であり、細胞内空間の主成分はK+、PO43-、有機酸イオン、Mg2+、およびタンパク質である。細胞外空間の電解質濃度は一定であると想定されている。したがって、特定の刺激が濃度の逸脱につながる場合、流体のシフト(主に毛細血管膜を横切る静水圧およびコロイド浸透力によって引き起こされる)により、元の設定値がほぼ即座に回復することが保証される。しかし、電解質濃度、つまりナトリウムが間質腔のどこでも同一であり、血漿濃度に匹敵するかどうかは疑わしいかもしれない。オークランドらは、血液量を調節するための中心的なメカニズムがあるかもしれないが、間質量を調節するための局所的に作用するメカニズムがあるかもしれないという仮説を立てた。この仮説は、ウシ軟骨の間質で最大450 mEq/LNa+の量を発見したモバシェリによる観察と一致する。
細胞外空間の電解質濃度を一定に維持するメカニズムとは対照的に、細胞内液と細胞外液の間だの電解質の関係は異なる。したがって、濃度が細胞内または細胞外空間のいずれかで変化する場合、主に小さな溶質、特にMa+およびCl-の浸透圧効果のみが流体の再分配を誘発し、細胞内または細胞外区画間の関係を維持する。
ナトリウム規制の従来の知識
ナトリウム調節に影響を与える様々な刺激があるかもしれないが、その中でも最も顕著なのはナトリウム摂取量である。2区画モデルによる従来の知識は、ナトリウム摂取量の増加は血清ナトリウム濃度の一時的な増加とそれに伴う体液貯留につながるというものである。その結果、細胞外容量が増加する。両方のメカニズムは、細胞外容量と血清ナトリウム濃度を増加させ、細胞外容量を一定に保つためにナトリウム排泄量を上昇させる(図1)。
図1 ナトリウムがどのように規制されているかという従来の知識。塩摂取量の増加は、細胞外容量の増加につながる。血清ナトリウム濃度の増加による高塩摂取量自体と細胞外容量の増加の両方がナトリウム利尿を引き起こす。
浸透圧的に活性または非活性のナトリウム規制?
しかし、1992年のドイツとロシアの共同宇宙ミッションの間に、宇宙飛行開始時のナトリウム排泄量の増加に関する一般的な理解とは対照的に、ナトリウム利尿が微小重力で減少したことを最初に発見した。そのミッションのフォローアップとして、我々の別のドイツとロシアの共同宇宙ミッションで代謝病棟の実験を続け、ミッション全体で毎日正のナトリウム・バランスを観察した。宇宙飛行士のナトリウム摂取量は180 mEq/dで15日間一定に維持した。これはドイツの平均的な通常の摂取量に匹敵するが、それでも高いナトリウム摂取量であると考えられている。地球上でのそれぞれの対照実験は13日間行われた微小重力では、ナトリウム・バランスは約50 mEq/dで正であり、体内に保持されるナトリウム量は750 mEqに達したが、対照実験ではナトリウムはほぼバランスが取れていた。驚くべきことに、微小重力でのナトリウム貯留は体液貯留を伴わなかった。これは等張性ナトリウム貯留が起こった場合に備えて約5 Lであったはずである。
これらのかなりの予想外の結果は、体液貯留のないナトリウム貯留が微小重力環境によって引き起こされるのか、それとも通常の重力条件下でも同様の結果が得られるのかという疑問につながった。最初の代謝病棟研究では、オープン・スタディ設計を選択し、塩摂取量を平均正常量の8日間の220 mEq/d塩摂取量から次の8日間の440 mEq/d塩摂取量まで増やし、さらに8日間の660 mEq/d塩摂取量での実験で終了した。水分摂取量は40 ml/kg,dの量で一定に保たれた。宇宙飛行での観測と比較して、8日間の塩摂取量を2倍および3倍(440 mEq/d塩摂取量および660 mEq/d塩摂取量)にすると、全体のナトリウム保持量はそれぞれ約700 mEqおよび1000 mEqになることが分った。ナトリウム貯留が体液貯留によって補われる場合、細胞外容量は研究の24日後に約12 L増加するはずである。しかし、細胞外容量は変化しなかった。これらの結果に基づいて、微小重力下での平均的な通常の塩摂取量と地球上での高い塩摂取量の両方がナトリウム排泄量の増加につながるという結論に達した。それにもかかわらず、ナトリウム排泄量の増加(腎臓、皮膚、および糞便を介した)は摂取量と一致せず、ナトリウムが体液貯留なしで保持されることを示している(図2)。同様の結果、すなわち、体液貯留のない正のナトリウム・バランスも、Titze
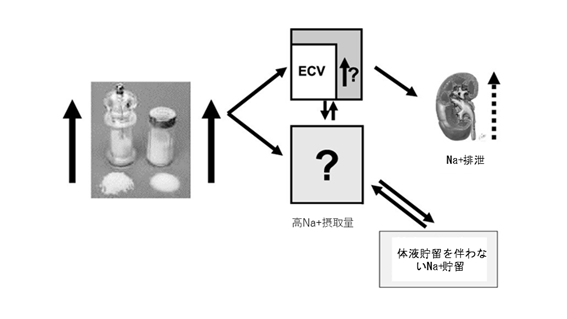
図2 体液貯留を伴わないナトリウム貯留の効果を含む体内のナトリウム調節の修正されたスキーム。 ECV=細胞外容量
らによって、宇宙飛行のような閉じ込められた状況がシミュレートされた隔離実験で説明された。浸透圧を変えずに、そして体液貯留に続いてナトリウムをどこに保持できるかという問題が残っている。Faberらは特定のグリコサミノグリカン、すなわち、コンドロイチン硫酸による作用の結合を調べた。彼等は浸透圧活性のない過剰なナトリウム結合の1つの可能性は、コンドロイチン硫酸などの高い負電荷を持つ高分子電解質への結合である可能性があると仮定した。彼等は塩化ナトリウム、塩化カリウム、塩化カルシウム、およびコンドロイチン硫酸へのそれぞれの潜在的な結合を研究した。彼等の結果は、「結合した陽イオンの量は、研究された濃度範囲にわたって一定であり、ナトリウムまたはカリウムのコンドロイチン硫酸の期間当たり約0.9当量、カルシウムの期間当たり1.3当量である。」ことを示している。彼等は、「現在の議論における結合カチオンは、浸透圧的に活性化するのを防ぐ方法で結合する可能性があると仮定した。Titzeらは動物実験で彼等の研究を続けた。彼等はSprague Dawleyラットを使用し、低(0.1%)または高(8%)の塩化ナトリウム固形飼料を与えた。人間での実験と同様に、彼等は体液貯留なしで正のナトリウム・バランスを観察した。しかし、彼等の研究では、彼等はラットの皮膚を剥がし、皮膚のナトリウムと水分の含有量を分析した。実際、保持されたナトリウムのほとんどは皮膚で発見された。これはFarberらが以前に示したように、グリコサミノグリカンが浸透圧的に不活性なナトリウム保持に重要な役割を果たす可能性があることを示唆している。さらに、Titzeらは低(0.1%)または高(8%)の塩化ナトリウムを8週間与えたSprague Dawleyラットの皮膚グリコサミノグリカン含有量とグリコサミノグリカン連鎖重合の主要酵素の変化を分析し、皮膚ナトリウムの増加が軟骨と皮膚中のグリコサミノグリカン含有量の増加と一致することを発見した。食事中の塩負荷は皮膚のコンドロイチン・シンターゼmRNAの増加とも一致した。
一方、SeeligerらおよびNguyenらは浸透圧的に不活性なナトリウム保持の可能性に疑問を投げかけている。Seeligerらは、「浸透圧的に不活性なNa+貯蔵が迅速なプロセスであることを示すように思われた。これまでのヒトでのHeerの研究データは、K+バランスが評価されなかったため、この貯蔵の肯定的な証明とは見なされなくなった。」と述べている。
SeeligerらやNguyenとKurtzによって提案されたように、体液貯留を伴わない正にナトリウム・バランスが負のカリウム・バランスによって補償されるかどうかの問題に加えて、別の質問が引き起こされる。「ナトリウム規制の従来の知識」のセクションで説明されているように、幾つかの研究で示されているが、塩摂取量の増加は細胞外容量拡張と同様に、血清ナトリウム濃度と水分保持の増加にもつながるという生理学的教科書の知識である。しかし、細胞外容量の増加を示すほとんどの研究は、平均的な正常または高摂取量ではなく、低ナトリウム摂取量から始まった。したがって、我々の代謝病棟でのさらなる研究では、塩摂取量の様々な開始レベルの影響を調べた。低摂取量(50 mEq/d塩化ナトリウム)から平均正常摂取量(200 mEq/d塩化ナトリウム)に塩摂取量を増やすと、我々の結果は従来の知識と一致し、体液貯留とともにナトリウム貯留にもつながる。しかし、平均正常量(200 mEq/d塩化ナトリウム)から開始し、塩摂取量をさらに非常に高い摂取量(550 mEq/d)に増やすと、ナトリウムも保持されるが、今回は、体液貯留はない。さらに、カリウム・バランスを分析したところ、カリウム・バランスはやや負であったが、正のナトリウム・バランスの22%しか説明できないことが分った。したがって、40 ml/kg日の一定の水分摂取量と組み合わせた高塩摂取量は浸透圧的に不活性なナトリウム保持につながると結論付ける。
浸透圧的に不活性なナトリウム保持の潜在的なメカニズム
前に述べたように、Titzeらは、ラットではナトリウムの上昇が軟骨と皮膚のグリコサミノグリカン含有量の増加に関与していることを説得力を持って示している。さらに、同じグループは、高塩摂取量後の4週間にわたる塩摂取量の減少が負に帯電した皮膚グリコサミノグリカン含有量の減少と関連していることを示した。したがって、浸透圧的に不活性なナトリウム保持は活発に調節された間質性陽イオン交換メカニズムと幾分結びついているように思われる。したがって、ボランティアで塩摂取量を低(50 mEq/d)から高摂取量(550 mEq/d)に変更した場合の皮膚生検におけるグリコサミノグリカン連鎖重合の幾つかの重要な酵素のmRNA発現を分析した。我々が発見したのは、グリコサミノグリカン連鎖重合酵素とヒアルロニダーゼの主要酵素のmRNA発現が2倍になったことである。グリコサミノグリカンがナトリウムに結合する場合、1950年代にすでにFaberらが述べているように、これは水素の放出につながり、周囲の組織のpH低下につながる可能性があり、おそらく全身レベルでのpHの低下につながる可能性がある。動脈血のpH、重炭酸塩、および塩基過剰量の分析は、塩摂取量が多いとこれらの量が大幅に低下することを示しており、低悪性度の代謝性アシドーシスの状態を示している。これらの結果に基づいて、与えられた研究条件下で、塩摂取量が多いと、ナトリウムがグリコサミノグリカンに結合することにより、浸透圧的に不活性なナトリウム保持が生じ、低悪性度の代謝性アシドーシスが生じると仮定する(図3)。
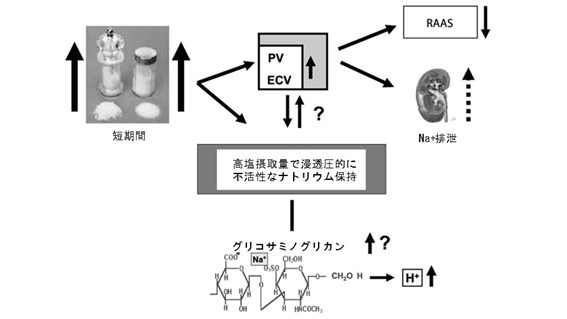
図3 最近の結果に基づくナトリウム規制の実際の理解のスキーム。塩摂取量の増加は低塩摂取量から高塩摂取量までの開始時に血漿量(PV)と細胞外量(ECV)を増加させる。しかし、既に高い塩摂取量からさらに高い塩摂取量まで開始する場合、血清ナトリウム濃度のさらなる上昇を回避するために、さらなるメカニズムを活性化する必要があるかもしれない。コンドロイチン硫酸のような間質腔内の高分子電解質はナトリウムに結合し、浸透圧的に不活性なナトリウム保持につながる可能性がある。その結果、水素が放出され、低悪性度も代謝性アシドーシスにつながる可能性がある。
RAAS=レニンーアンジオテンシンーアルドステロン系
一定期間の塩摂取量の減少がグリコサミノグリカンからのナトリウム放出にもつながるかどうかと言う疑問が残る。肥満の女性患者でGarnettらによって行われた研究からの最初の結果は、完全な飢餓の期間中に浸透圧的に不活性なナトリウムが交換に利用できるようになった可能性があることを示唆している。したがって、塩摂取量が多く、浸透圧的に不活性なナトリウム保持期間が経過した後、塩摂取量を減らすと結合したナトリウムが放出される可能性があると仮定した。したがって、高塩摂取量段階に続いて、前述の研究で50 mEq/dの低塩摂取量による別の6日間の期間を追加した。その研究期間の最初の数日間にナトリウムが失われたが、水が同時に失われたため、このナトリウム損失は浸透圧的に活発なナトリウム損失に起因する可能性がある。平均的な通常および高塩摂取量段階で保持されたナトリウムの約75%が継続的に保持され、血液中pH、重炭酸塩、および塩基過剰量は最初の低塩摂取量段階の量に戻った。これらのデータはSchafflhuberらによって公開された動物データによって支持されている。彼等はラットの1週間の低塩摂取量では、保持されたナトリウムを放出するのに十分ではなかったことを示している。しかし、4週間の低塩摂取量はナトリウム損失と、それに伴う負に帯電した皮膚のグリコサミノグリカン含有量の減少を促進した。現在の発見にもかかわらず、どの刺激が最終的にナトリウム放出を誘発するかについては未解決の問題のままである。
結論
最近の調査結果に基づいて、2区画モデルはナトリウム調節を理解するのにもはや十分ではない可能性があり、間質空間に位置する調節メカニズムがモデルに含まれている可能性があると結論付ける。